خلاصه
نئوسپورا کانینم (Neospora Caninum)، تک یاخته ای است که اخیراً به عنوان عامل بیماری زای سقط جنین در گاو و فلج عصبی – عضلانی اندامهای مختلف بخصوص اندامهای خلفی سگ شناخته شده است و در طیف وسیعی از حیوانات مختلف نیز وجود نئوسپوروزیس ناشی از نئوسپورا کانینم گزارش شده ولی هنوز تک یاخته مزبور بعنوان یک زئونوز (Zoonosis) در نظر گرفته نشده است. تا سال 1988 آنطوریکه باید و شاید اطلاع دقیقی از این بیماری وجود نداشته و در بیشتر انتشارات تک یاخته مزبور اشتباهاً جزو توکسوپلاسما گوندی عامل توکسوپلاسموزیس شرح داده شده است زیرا علائم مشخصه ای که وجه تمایز این تک یاخته از تک یاخته توکسوپلاسما گوندی و گونه های مختلف جنس سارکوسیستیس باشد تا تاریخ مزبور گزارش نشده بود. انتقال تک یاخته تنها از طریق جفت به جنین در حیوان آبستن مورد تائید است و راههای دیگر انتقال هنوز به طور قاطع به ثبوت نرسیده است. در این نوشته تاریخچه، ساختمان تک یاخته، بیولوژی و چرخه زندگی، نشانیهای بیماری، روشهای تشخیصی، درمان، پیشگیری و کنترل نئوسپوروزیس در گاو، گوسفند، بز، سگ و موش شرح داده شده است.
تاریخچه
تک یاخته نئوسپورا کانینم در دو دهه اخیر شناخته شده و انگل حیوانات اهلی و حیوانات دست آموز می باشد درسال 1987 تول و جفری(Tool & Jeffry,1987 ) در گوساله نوزاد بسیار ضعیفی مشکوک به وجود تک یاخته جدیدی شدند. در بررسیهای انجام شده با استفاده از تست ایمنو پراکسیداز (Immuno peroxidase test ) مشخص گردید که گوساله مورد آزمایش به توکسوپلاسموزیس و سارکوسیستوزیس آلوده نبوده است و پس از بررسیهای متعدد دیگر به وجود نئوسپوروزیس ناشی از نئوسپورا کانینم پی بردند.
در سال 1988 دبی (Dubey) و همکاران و گروهی دیگر از محققین با بررسی های آسیب شناسی بافتهای آسیب دیده در حیوانات بیمار و انجام تستهای ایمنوهیستوشیمی (Immunohistochemistry test ) ایمنو فلورسانت غیر مستقیم(Indirect Immunofluorescent test )، الیزا( Enzyme Linked immunosorbent assay) و تستهای مقایسه ای در مورد عدم وجود IBR ، اسهال ویروسی (BVD ) و لپتوسپیروزیس ، برای اولین بار به توصیف نئوسپوروزیس ناشی از نئوسپورا کانینم پرداختند و اعلام نمودند که تک یاخته مزبور عامل سقط جنین در نشخوار کنندگان بزرگ بخصوص گاو بوده و در سگ نیز باعث فلج عصبی – عضلانی (Neuromuscular Paralysis) میگردد. بررسی های مربوط به تاریخچه شناسایی نئوسپورا کانینم در جدول شماره یک ارائه شده است.
جدول شماره 1: معرف تاریخچه شناسایی نئوسپورا کانینم و نئوسپوروزیس می باشد.
| ردیف | شرح | مراجع و ماخذ |
| 1 | شناسایی بیماری برای اولین بار در سگ در نروژ(بدون نامگذاری) | 1)Berka’s et al(1984) |
| 2 | پیشنهاد نامگذاری نئوسپورا و گونه نئوسپورا کانینم جهت تک یاخته جدا شده از سگ در آمریکا | 2)Dubey et al(1988a) |
| 3 | نئوسپورا کانینم جدا شده در کشت سلول و موش طبق ضوابط مربوط به شناسایی بیماری ها توسط کخ(Kock’s Postulates) | 3) Dubey et al(1988b) |
| 4 | کاربرد روش ایمونو فلورسانت غیر مستقیم در تشخیص سرولوژی نئوسپوروزیس | 4)Lindsay and Dubey(1988c) |
| 5 | کاربرد روش هیستوشیمی در تشخیص و شناسایی نئوسپورا کانینم در بافتهای حیوانات مشکوک به آلودگی | 5) Lindsay and Dubey(1988b) |
| 6 | شناسایی نئوسپورا کانینم بعنوان عامل سقط جنین در گاو | 6)Thilsted and Dubey(1989) |
| 7 | انتقال تجربی نئوسپورا کانینم از طریق مادر آلوده و آبستن به جنین در سگ ، گربه،گوسفند و گاو | 7) Lindsay and Dubey(1989b,1990c) |
| 8 | بررسی های دارویی جهت درمان نئوسپوروزیس | 8) Lindsay and Dubey (1989c,1990a) |
| 9 | بررسی های تجربی نئوسپوروزیس در حیوانات مدل مثل موش و گربه | 9) Lindsay and Dubey(1988d,1990c) |
| 10 | شناسایی نئوسپورا کانینم در سگ نروژی | 10)Berker’s and Dubey(1991) |
| 11 | شناسایی نئوسپورا به عنوان عامل مهم سقط جنین در گاو در کالیفرنیا | 11)Andersen et al(1991),Barr et al(1994b) |
| 12 | نئوسپورای جدا شده از جنین های سقط شده در گاو و ایجاد بیماری با سویه جدا شده | 12)Conard et al(1993a)Barr et al (1994b) |
| 13 | بررسی نئوسپورا کانینم بدون علائم کلینیکی مشخص در گاو | 13)Pare et al(1994) |
| 14 | کاربرد تست الیزا جهت تشخیص نئوسپوروزیس در سگ و گاو | 14)Bjorkmay at al(1994a) Par èt al(1995b),Dubey et al (1996a) |
| 15 | تولید پروتئین نوترکیب نئوسپورا کانینم جهت تشخیص نئوسپوروزیس | Lally et al(1996a) |
(اقتباس از مقاله دبی و همکاران 1996 مجله انگل شناسی دامپزشکی جلد 67 از صفحه 1 تا 59)
ساختمان تک یاخته
در تک یاخته نئوسپورا کانینم سه شکل اصلی:تاکی زوئیت (Tachyzoites )،برادی زوئیت(Bradyzoites) و کیست بافتی( Tissue cysts ) شناسایی شده است
تاکی زوئیت ها به اشکال بیضی ،کروی یا هلالی دیده می شوند و بر حسب اینکه تک یاخته در چه مرحله ای از تقسیم باشد اندازه آن برابر 5-1 × 7-3 میکرون میباشد تک یاخته به روش اندو دیوژنی (Endodyogeny ) به دو زوئیت یا بیشتر تقسیم می گردد. تاکی زوئیت ها در انواع سلولها: سلولهای عصبی، ماکروفاژها، فیبروبلاست ها، سلولهای پوششی جداره رگها، سلولهای پوششی لوله های مالپیگی کلیه و سلولهای کبدی جایگزین می گردند و به عبارت دیگر تاکی زوئیت های تک یاخته نئوسپورا کانینم همه سلول دوست هستند و می توانند در فاصله زمانی بسیار کوتاه حدود پنج دقیقه به درون سلولهای دلخواه نفوذ کرده و در سیتوپلاسم آنها در داخل واکوئل پارازیتوفوروس(Parasitophorous Vacuole ) جایگزین شوند. امکان دارد تاکی زوئیت ها در درون سلول میزبان در داخل تعداد متعددی واکوئل پارازیتوفوروس باشند. در میکروگراف های تهیه شده با میکروسکوپ الکترونی امکان دارد واکوئل های واجد تاکی زوئیت ها بطور کامل شناسایی نشوند و بصورت توده های بی شکل (Artifacts) نشان داده شوند. ضمناً در درون واکوئل ها ممکن است تعداد کم و زیادی شبکه رشته های لوله ای وجود داشته باشد.
با استفاده از میکروسکوپ الکترونی تاکی زوئیت ها واجد سه لایه غشایی مانند (Plasmalemma)، دو حلقه راسی(Apical complex) یک کونوئید(Conoid)، یک حلقه قطبی(Polar ring)، میتوکندری (Mitochondria) ،حدود 150 میکرونم(Micronemes)، 8 تا 18 روپتری(Rhoptries) ،دستگاه گلژی(Golgi complex)، رشته های اندوپلاسمیک (Endoplasmic Reticulum) ، هسته(Nucleous) و هستک(Nucleolus) می باشند بعضی از روپتروی ها کشیده شده و تا قسمت خلفی هسته ادامه دارند از طرفی روپتری ها واجد توده الکترونی متراکم بوده و دو تا چهار برابر ضخیم تر از میکرونم ها هستند علت اینکه محققین تعداد روپتری ها را متغیر شناسایی نموده اند این است که بعضی مواقع روپتری ها با گرانولهای موجود در سیتوپلاسم تک یاخته اشتباه می شوند. تعداد میکرونم ها نیز بسیار متغیر بوده و بعضی از آنها نسبت به غشا ء درونی تک یاخته به صورت نسبتاً عمودی قرار گرفته اند در بین تعدادی از تاکی زوئیت ها توده های متراکم الکترونی واجد میکرونم های آزاد و مجموعه ای از ساختمان های لوله ای مانند مشاهده می گردد.
میکروپرها(Micropores) در تاکی زوئیتهایی که مستقیماً از بافت حیوان جدا شده اند دیده نمی شوند ولی در تاکی زوئیت های مربوط به کشت سلول قابل رویت هستند.
برادی زوئیت ها: برادی زوئیت ها کشیده هستند و اندازه آنها به حدود8/1-1 × 8-6 میکرون می رسد کلیه اندامچه های تاکی زوئیت در برادی زوئیت ها مشاهده می گردند معذالک تعداد روپتری ها در آنها کمتر است برادی زوئیت ها واجد دانه های آمیلوپکتین(Amylopectin) بوده که با رنگ پاس(Pas) رنگ می گیرند هسته در برادی زوئیت ها در قسمت خلفی قرار دارد. میکرونم ها غالباً بطور عمودی بر غشاء درونی سیتوپلاسم جای دارند.
کیست های بافتی (Tissue cysts): کیست های بافتی غالباً شکل بیضوی و گرد دارند و اندازه آنها به حدود 107 میکرون می رسد و در بافتهای عصبی (مغز، نخاع و رشته های عصبی شبکیه) دیده می شوند. دیواره کیست از بافت نرم تشکیل شده و ضخامت آن به حدود 4 میکرون می رسد و در عفونت های تازه ایجاد شده ضخامت کیست کمتر ولی در در عفونت هایی که مدت زمان بیشتری از آنها گذشته باشد ضخامت بیشتری دارند. دیواره کیست از ساختمانهای لوله ای مانندی تشکیل شده ولی سپتا (Septa) ندارد و ضمناً خاصیت رنگ آمیزی با املاح نقره را دارا می باشد، به عبارت دیگر آرژیروفیلیک(Argyrophilic) می باشد.
بیولوژی و چرخه زندگی
سگ تنها میزبان اصلی تک یاخته نئوسپورا کانینم می باشد و تک یاخته می تواند طیف وسیعی از گونه های مختلف حیوانات را آلوده نماید. در طبیعت آلودگی در سگ و گاو، گوسفند، بز، اسب و گوزن دیده شده است و بطور تجربی نیز عفونت ناشی از تک یاخته نئوسپورا کانینم را در موش رت، سگ، روباه، بز، گربه، گوسفند، کایوت(Coyotes) ،خوک ، جربیل(Gerbils)،خرگوش و میمون ایجاد کرده اند. سگ می تواند به عنوان میزبان واسط نیز در چرخه زندگی تک یاخته نقش داشته باشد پرندگان گوشتخوار همانند باز شکاری،کرکس و جغد می توانند به عنوان مخزن و منشاء انتشار نئوسپوروزیس در مزرعه باشند. انتقال بیماری عمودی است یا به عبارت دیگر انتقال در حیوان آبستن از طریق جفت به جنین صورت می گیرد و انتقال بیماری در آبستنی های بعدی نیز تکرار می گردد.
نئوسپورا کانینم تک یاخته ای است که از نظر ساختمانی شباهت زیادی به توکسوپلاسما گوندی داشته ولی از نظر آنتی ژنی از توکسوپلاسما گوندی قابل تشخیص است. انتقال از راه جفت بطور تجربی در سگ،گوسفند و موش مورد بررسی قرار گرفته است و هر گاه گربه را قبل از آبستنی با نئوسپورا کانینم آلوده نمایند، تک یاخته می تواند پس از آبستنی از طریق جفت به جنین گربه منتقل گردد. در گربه های آبستن که از طریق زیر جلدی، پرده صفاقی، داخل عضلانی، داخل رگی و راه خوراکی به نئوسپوروزیس آلوده شده بودند تاکی زوئیت های نئوسپورا کانینم در رحم و جفت آنها مشاهده شده است.
– کیست های نئوسپورا کانینم بعلت داشتن جدار خارجی ضخیم در چهار درجه حرارت بمدت چهارده روز فعال باقی می مانند و برادی زوئیت های درون آنها نسبت به محلول پپسین و اسید کلریدریک(Hcl-Pepsine) مقاوم هستند. بعضی مواقع امکان دارد جنین های آلوده شده از طریق جفت زنده باقی بمانند و گوساله های نوزاد آنها بطور طبیعی رشد نمایند. در واقع عفونت ناشی از نئوسپورا کانینم در چنین حیواناتی غیر قابل تشخیص باقی می ماند و حتی امکان دارد از آنها برای تکثیر و زاد و ولد (Breeding) گوساله ها نیز استفاده نمایند.
دو الگوی متفاوت در بروز بیماری دخالت دارند. در الگوی اول سقط جنین بصورت اپیدمی است(Epidemic abortion) که تعداد زیادی از گاوهای آبستن موجود در گله در فاصله زمانی کوتاه حدود چند هفته متوالی جنین های خود را سقط می نمایند. در الگوی دوم سقط جنین بصورت اندمیک (Endemic abortion) است که در تعداد محدودی از گاوهای آبستن موجود در گله شروع شده و در طی مدت طولانی، ماه ها بلکه سالها ادامه دارد. در گله هایی که سقط جنین بصورت اپیدمیک ظهور می یابد ممکن است علوفه و آب آلوده مهمترین عوامل احتمالی انتقال عفونت باشند. وجود سگها در مزرعه به عنوان یک عامل مهم در گسترش عفونت نئوسپورا کانینم در نظر گرفته شده است عوامل دیگری که احتمال دارد به عنوان عوامل خطرزا مد نظر باشند عبارتند از طیور، خرگوش،گربه ،موش اصلاح شده، موش رت، ضعف مدیریت، تغذیه نامناسب، دفع نشدن بموقع جنین های سقط شده به طریق بهداشتی و افزایش درجه حرارت محیط (افزایش درجه حرارت محیط می تواند در سرعت تبدیل اووسیت های ناقص به اووسیت های کامل نقش موثری داشته باشند) در نمودار شماره یک چرخه زندگی نئوسپورا کانینم نشان داده شده است و بر مبنای این نمودار سگ به عنوان میزبان اصلی و احتمالاً به عنوان میزبان واسط مورد تایید می باشد چرخه زندگی تک یاخته نئسپورا کانینم بشرح زیر می باشد:
پس از خوردن کیست های بافتی توسط میزبان اصلی (سگ) مراحل اولیه تقسیمات جنسی در دستگاه گوارش و در درون سلولهای پوششی شروع شده و در نهایت اووسیت های ناقص و بدون هاگ تشکیل می گردد سپس اواسیست های ناقص آزاد شده همراه با مدفوع به خارج دفع می شوند و در صورت مساعد بودن محیط (درجه حرارت و رطوبت مناسب) اووسیستها به سرعت تکامل یافته و هاگدار می گردند. هر اووسیست کامل شامل دو اسپوروسیست و هر اسپوروسیست شامل چهار اسپوروزوئیت می باشد. مدت زمان دوام اووسیست های کامل ، زنده و فعال در محیط خارج تقریباً نا مشخص است هر گاه میزبانهای واسط همانند گاو با خوردن غذا و آب دارای اووسیست کامل به نئوسپورا کانینم آلوده گردند در دستگاه گوارش آنها اووسیسته پاره شده و اسپوروزوئیت های عفونی زا آزاد می گردند و سپس اسپوروزوئیت ها به سرعت تغییر شکل پیدا کرده و تبدیل به تاکی زوئیت ها شده و به سلولهای میزبان نفوذ کرده و به سرعت رشد می نمایند و با متلاشی شدن سلولهای واجد تک یاخته، تاکی زوئیت های آزاد شده به سلولهای دیگر حمله می نمایند. تاکی زوئیت ها بیشتر در سلولهای عصبی، ماکروفاژها ، فیبروبلاست ها ، سلولهای پوششی مویرگها، سلولهای عضلانی قلب و جفت حیوانات حساس و آبستن جایگزین می گردند.ا ز طرفی تاکی زوئیت ها می توانند از طریق جفت به جنین وارد شده و در اعضاء مختلف جنین نیز نفوذ نمایند. پس از گذشت مدت زمان نامشخصی دستگاه ایمنی دام شروع به فعالیت نموده و با ایجاد جوابهای ایمنی درصدد متلاشی شدن تاکی زوئیت ها می شود لذا تاکی زوئیت ها به منظور فرار از تاثیر سوء جوابهای ایمنی دام تبدیل به برادی زوئیت ها شده و جدار آنها را پوشش نسبتاً ضخیمی فرا گرفته و تبدیل به کیست های بافتی می گردند. کیست های بافتی بمدت طولانی در بافتهای مختلف بخصوص سلولهای عصبی باقی می مانند و هر گاه به دلایل مختلفی سیستم ایمنی دام در مبارزه با نئوسپورا کانینم و میکروارگانیسم های دیگر اعم از ویروس، باکتری، تک یاخته و قارچ و عوامل دیگر تضعیف گردد برادی زوئیت ها مجدداً تبدیل به تاکی زوئیت ها شده و پس از آزاد شدن از کیست به سلولهای مختلف حمله کرده و در آنها جایگزین و تکثیر می یابند و در نهایت باعث متلاشی شدن سلولها و آزردگیهای نسجی می گردند.
تاکی زوئیت های موجود در جفت به جنین منتقل می گردند و با سقط جنین و خورده شدن جفت و جنین آلوده توسط سگ سالم کیست ها پاره شده و برادی زوئیت ها تبدیل به تاکی زوئیت ها شده و پس از طی مراحل جنسی در مرحله نهایی اواوسیت ها تشکیل می گردند و چرخه زندگی تک یاخته با دفع اواوسیت های آلوده ادامه می یابد.هر گاه گوساله ها بطور تجربی از طریق خوراکی با نئوسپورا کانینم جداشده از مدفوع سگ آلوده شوند پس از گذشت 2 تا 4 هفته تیتر پادتن نئوسپورا کانینم در گوساله های یاد شده مثبت می گردد.در تجربه دیگر هر گاه به گوساله ها کلستروم آلوده به تاکی زوئیت ها خورانده شود سرم های گرفته شده از گوساله های مزبور پس از گذشت دو هفته تیتر مثبت پادتن نئوسپورا کانینم را نشان می دهند و این خود می تواند معرف آن باشد که گوساله های نوزاد از طریق خوردن کلسترم(Colostrum) دام مبتلا به نئوسپورا کانینم آلوده می شوند معذالک ضرورت دارد یادآور شویم که این مکانیسم انتقال باید مجدداً مورد بررسی دقیق تری قرار گرفته شود.
تستهای ایمونو هیستوشیمی(Immunohistochemistry test) و PCR مشخص نمودند که نئوسپورا کانینم در بیشتر حیوانات همانند گوسفند، بز، اسب ،گوزن ، روباه ، راکون و کایوت وجود دارد بررسی های دیگر نشان دادند که کایوت (Coyote) هم می تواند بعنوان میزبان اصلی و سایر علفخواران بغیر از گاو نیز به عنوان میزبان واسط و پرندگان گوشتخوار بعنوان مخازن تک یاخته در نظر گرفته شوند.
کشت تک یاخته در محیط خارج
نئوسپورا کانینم در مونوسیت ها و سلولهای پوششی جدار داخلی سرخرگهای قلب و ریه گاو، سلولهای ورو (Vero cells) و سلولهای گوناگونی که بصورت لاین (Cell lines) در آمده اند و همچنین سلولهای فیبروبلاست انسان رشد می نمایند ولی سرعت رشد و تکثیر تک یاخته در مونوسیتهای گاو بمراتب بهتر می باشد. تاکی زوئیت های بدست آمده از کشت برای حیوانات حساس عفونی زا هستند و تداوم پاساژ در محیط کشت حتی برای مدت 8 سال تاثیری در کم شدن قدرت بیماریزائی آنها ندارد. تاکی زوئیت های کشت شده را می توان با استفاده از مواد حفاظت کننده همانند گلیسیرین و دی متیل سولفوکسید ( DMS) در برودت های پایین (70-) و ازت مایع بمدت طولانی نگهداری نمود.
ارتباط میزبان با انگل(Host-Parasite relationship)
با افزایش و تکثیر تاکی زوئیت های نئوسپورا کانینم در گاو، سگ و احتمالاً میزبانهای دیگر در طی مدت زمان کوتاهی در اعضاء مختلف بدن دام بخصوص بافتهای عصبی-عضلانی جراحات ماکروسکوپی قابل رویت هستند و در نهایت آزردگیهای ایجاد شده باعث متلاشی شدن و مرگ سلولهای میزبان می گردند. سلولهای عصبی نخاع، جمجمه و همچنین رشته های عصبی که با ماهیچه ها ارتباط دارند بیشتر مورد حمله قرار می گیرند و قدرت انتقالی سلولهای عصبی به تدریج نقصان یافته و یا اینکه به کلی از بین می رود (Affecting the conductivity of affected cells) کیست های بافتی تحت تاثیر واکنش های سلول میزبان قرار نمی گیرند و مدت زمان ماندن آنها در درون سلولهای میزبان نا مشخص است و تجربیات انجام شده نشان دادند که کیست های موجود در مغز موش حدود یک سال می توانند دوام داشته باشند.
آنتی ژن
بارتا و دوبی در سال 1992 (Barta and Dubey) با استفاده از روش وسترن بلات (Western Blot) و پادتن های مونوکلونال و پلی کلونال تهیه شده از خرگوش که با تاکی زوئیت های نئوسپورا کانینم ایمن شده بودند حداقل 20 نمونه پروتئین به وزن ملکولی 6 الی 80 کیلودالتن (KD 80-16) جدا کرده اند و آنتی ژنهای جدا شده بیشتر در ارتباط با روپتری ها، توده های متراکم و شبکه لوله های غشایی درون واکوئل های پارازیتوفوروس بوده است و از طرفی با استفاده از روشهای یاد شده به این نتیجه رسیدند که گرچه امکان دارد آنتی ژنهای مشترک بین توکسوپلاسما و نئوسپورا وجود داشته باشد ولی آنتی ژنهای غالب در برادی زوئیت ها و تاکی زوئیت های توکسوپلاسما و نئوسپورا از یکدیگر متمایز هستند.
بیولوژی ملکولی
بررسی های بیولوژی ملکولی بیشتر در مورد رده بندی و تکمیل تستهای تشخیصی تک یاخته مورد استفاده قرار گرفته و مناسبترین و کاملترین تست مورد آزمایش در این زمینه تست PCR می باشد.
نشانیهای بیماری
تنها نشانه مشخص کلینیکی در نئوسپوروزیس سقط جنین گاوهای آبستن آلوده می باشد هر گاه گاو سالمی به عفونت نئوسپورا کانینم آلوده گردد بر حسب اینکه دام مبتلا آبستن نباشد و یا بر حسب اینکه آبستن باشد و آبستنی دام در ماه های اول وسوم، ماه های سوم و هفتم و یا ماههای آخر باشد چهار پدیده مشخص بیماری ممکن است بروز نماید:
الف- گاو مبتلا فاقد علائم کلینیکی است.
ب- جنین ممکن است در رحم تلف شده سپس جذب یا دفع گردد.
ج- زاییدن گوساله ضعیف
د- بدنیا آوردن گوساله ظاهراً سالم و بدون علائم کلینیکی مشخص نئوسپوروزیس
ویژگیهای چهار مشخصه ذکر شده به تفصیل در ذیل شرح داده می شود:
الف- هر گاه گاو سالم در زمان آلودگی آبستن نباشد عفونت ایجاد شده علائم کلینیکی ایجاد نمی نماید ولی تست سرمی مثبت بوده و ایمنی سلولی توسعه پیدا کرده و همراه با افزایش سلولهای درگیر در ایمنی سلولی و افزایش گاما اینترفرون، گسترش و افزایش تک یاخته در درون سلول میزبان محدود می گردد و تک یاخته برای تداوم بقاء خود و مقاومت در مقابل جواب های ایمنی میزبان از فرم فعال یعنی تاکی زوئیت ها به برادی زوئیت ها تبدیل شده و پوشش نسبتاً ضخیمی برادی زوئیت ها را در بر گرفته و تک یاخته به شکل کیست بافتی در می آید و جواب های ایمنی میزبان چندان اثر سوئی بر ضد کیست های بافتی ندارد.
ب- هر گاه دام سالم در زمان آلودگی به نئوسپوروزیس، آبستن باشد و سن جنین از سه ماه بیشتر نباشد به احتمال به یقین مرگ زودرس جنین اتفاق می افتد زیرا سیستم ایمنی مادر فعالیت بیشتری را شروع کرده و با افزایش و تکثیر سلولهای درگیر ایمنی سلولی و افزایش گاما اینترفرون به مبارزه با آنتی ژنهای تک یاخته ادامه می دهد ولی بعلت آسیب های شدید جفت ارتباط بین مادر و جنین قطع شده و در نتیجه رشد جنین متوقف و مرگ آن فرا می رسد.
ج- هر گاه دام سالم در زمان آلودگی به نئوسپوروزیس آبستن باشد و سن جنین بین سه ماه و هفت ماه باشد بر حسب اینکه دام در چه ماهی از آبستنی باشد عفونت نئوسپورا کانینم باعث سقط جنین یا زاییدن گوساله زنده، لاغر و غیر طبیعی می گردد. در چنین مرحله آبستنی، جنین واجد سیستم ایمنی ناقص بوده و قادر به مبارزه کامل جهت دفع عفونت نیست و بعلت سایتوکاین های مربوط به سلولهای T تیپ 2 در جفت و تضعیف جواب های ایمنی مربوط به سلولهای T تیپ یک مادر و یا به عبارت دیگر پایین آمدن قدرت دفاعی سیستم ایمنی مادر نئوسپورا کانینم تکثیر یافته و متعاقب آن با تهاجم تاکی زوئیت های تک یاخته در جفت و اندامهای مختلف جنین و عدم توانایی سیستم ایمنی گوساله آزردگیهای قابل توجهی در جنین بوجود آمده و سقط جنین اتولیز شده حاصل می گردد ولی هر گاه سیستم ایمنی نسبتاً بطور کامل گسترش یافته باشد گوساله غیر طبیعی با وزن کم و شکل گیری ضعیف سیستم مرکزی اعصاب و ظهور انسفالومیلیتیس (Encephalomyelitis) زاییده می شود که امکان دارد در طی مدت زمان کوتاهی تلف گردد.
د- هر گاه دام سالم در زمان آلودگی به نئوسپوروزیس در ماههای آخر آبستنی باشد وجود عفونت ممکن است باعث زاییده شدن گوساله ضعیف یا طبیعی شود و سرم چنین گوساله دارای تیتر مثبت پادتن تک یاخته می باشد و سیستم ایمنی قادر به کنترل عفونت شده و متعاقب آن علائم بیماری محدود شده و یا اینکه علائمی در گوساله نوزاد مشاهده نمی گردد.
نقش فصل در سقط جنین
نئوسپوروزیس در تمام طول سال امکان دارد بروز نموده و در دامهای آبستن باعث سقط جنین بشود. در کالیفرنیا بیشتر موارد سقط جنین در فصل زمستان و در هلند بیشتر در اواخر تابستان و اوایل پاییز اتفاق می افتد. بنابراین فصل بخصوصی در ایجاد موارد سقط جنین دخالت ندارد.
سقط جنین در گاو پرواری و گاو شیری
در هر دو نوع گاو اعم از پرواری و شیری موارد نئوسپوروزیس گزارش شده است در کالیفرنیا موارد سقط جنین بیشتر در گاوهای شیری (Dry Lot daries ) که بطور بسته و محدود پرورش می یابند دیده شده است در حالی که بر عکس در هلند بیشتر موارد نئوسپوروزیس در گاوهای شیری که در مرتع بودند گزارش شده است. در یک بررسی در استرالیا در بین 759 مورد سقط جنین ناشی از نئوسپوروزیس در 26 گله آلوده 59% از گاوهای آلوده گاوهای شیری و 41% گاوهای پرواری بوده اند.
سن گاو
سقط جنین ناشی از نئوسپوروزیس بیشتر در حیواناتی به سن 8 سالگی اتفاق می افتد و در نیوزلند سقط جنین بیشتر در گاوهایی به سن چهار سالگی رخ داده است معذالک باید اضافه نماییم که گزارشی حاکی از سقط جنین های نئوسپوروزیس در سن بخصوصی در دام در دسترس نیست.
جراحات جنین های سقط شده
در جنین های سقط شده مربوط به نئوسپورا کانینم جراحات تورمی و متلاشی شدن و تحلیل رفتن کلیه بافتهای جنین مشاهده می گردد اما بیشترین آزردگیهای بافتی در سیستم اعصاب مرکزی، قلب، ماهیچه های مربوط به اسکلت استخوانی و کبد رخ میدهد. جراحات ماکروسکوپی کمیاب هستند و ممکن است در قلب و عضلات مربوط به اسکلت استخوانی و مغز مشاهده شود. در گوساله نوزاد مرده زاییده شده قلب بزرگ شده و کانونهای رنگ پریده سفید در عضلات مربوط به اسکلت بدن و قلب دیده می شود. در مغز هم کانونهای نکروزی رنگ پریده و یا کاملاً تیره مشاهده میگردد و غالباً جنین های سقط شده اتولیز (Autolysed) یا مومی شکل (Mummified) می شوند. جراحات مشخص نئوسپوروزیس در سیستم اعصاب مرکزی عبارتند از انسفالیت ،تجمع کانونهای واجد مونونوکلئر(سلولهای یک هسته ای) در اطراف مراکز نکروز شده و افزایش گلیال(Glial Proliferation) بخصوص در ماههای آخر آبستنی مشاهده می گردد. در بررسیهای انجام شده در 82 جنین سقط شده، انسفالیت مغز(Encephalitis) و نسبت 100% ، تورم عضله قلب (Myocarditis) به نسبت 100%، تورم کبد (Hepatitis) به نسبت 62%، تورم جفت(Placentitis) به نسبت 53%، تورم کلیه(Nephritis) به میزان 66% و تورم عضلانی (Myositis) به نسبت 72% و پنومونی (Pneumonia) به میزان 44% مشاهده شده است. در یک بررسی که اخیراً بر روی 90 جنین سقط شده در گاو در هلند انجام شده و با آزمایشهای انگلی وجود نئوسپوروزیس تائید گردید جراحات بافتی و توزیع انگل در مغز، قلب و کبد مقایسه شده اند در 83 مورد (90%) در هر سه عضو:مغز، قلب و کبد جراحات وجود داشته در حالیکه در هفت مورد باقی مانده جراحات فقط در دو عضو (مغز و قلب) مشاهده شده است. جراحات مشاهده شده عبارت بودند از انسفالیت غیر چرکی (Non suppurative encephalitis) با تعداد زیادی کانونهای نکروزه جراحات قلبی (Myocardial necrosis) که غالباً به علت لیز شدن قابل مشاهده نبوده اند تورم کبد همراه با نفوذ سلولهای تک هسته ای و کانونهای نکروز سلولی کبد (Hepatocellular necrosis) دیده می شود.
معمولاً جراحات غالباً در مغز و قلب قابل رویت بوده ولی در سایر اعضاء جنین و همچنین جفت به ندرت یافت شده است ضمناً یادآور می شود که کیست های بافتی کوچکی به اندازه 10 میکرون در مغز جنین گاوی که 23 روز قبل از سقط آلوده شده بود دیده شده است .
نئوسپوروزیس در گوساله هایی که از طریق جفت آلوده شده اند.
گوساله های نوزاد آلوده ممکن است با نشانیهای عصبی همراه باشند و وزن آنها کمتر از وزن طبیعی گوساله های نرمال بوده و قادر نباشند رشد نمایند و یا اینکه بدون علائم کلینیکی باشند. در گوساله های مریض پاهای عقب و دستها ممکن است خم شده و یا اینکه کاملاً کشیده و از هم باز باشند و برای ایستادن گوساله تعادل نداشته باشد. در تمام گوساله هایی که از طریق مادر به نئوسپوروزیس آلوده می شوند و زنده بدنیا می آیند بیماری بیشتر به سیستم اعصاب مرکزی محدود می گردد. جراحات ماکروسکوپی شامل مالاسیا(Malacia) نرم شدن قسمتهای مختلف بدن، انحراف یا باریک شدن ستون فقرات می باشد. جراحات میکروسکوپی عبارتند از انسفالیتیس غیر چرکی و گلیوزیس(Gliosis) ،بیشتر کیستهای بافتی در گوساله های نوزاد سه روزه گزارش شده و کلاً کیستهای بافتی بیشتر در رشته های عصبی نخاع و هم چنین در مغز جنین دیده می شوند. تورم و تغییر شکل پیدا کردن عضلات نتیجه تحلیل رفتن آنها می باشد (Muscle degeneration). بیشتر گوساله هائیکه علائم کلینیکی حاد دارند در طی چهارهفته اول زندگی تلف می شوند. از طرفی امکان دارد گسترش نئوسپوروزیس به نوع سویه نئوسپورا کانینم، مرحله آبستنی و وضع ایمنی مادر در زمان عفونت بستگی داشته باشد.
تکرار انتقال نئوسپوروزیس از مادر به جنین در گاو آلوده
احتمال انتقال نئوسپوروزیس از مادر به جنین در دفعات مکرر از احتمال تکرار سقط جنین در گاو آلوده بیشتر است. در یک بررسی چهار گاوی را که قبلاً جنین های آلوده سقط کرده بودند انتخاب نمودند. پنج راس گوساله ای را که مجدداً از چهار گاو مورد نظر زاییده شده بودند تحت بررسیهای لازم قرار دادند. در مغز سه راس از این پنج گوساله وجود نئوسپورا کانینم به ثبوت رسید و در سرم دو راس گوساله باقیمانده که قبل از خوراندن آغوز تهیه شده بود تیتر بالای پادتن نئوسپورا کانینم مشخص گردید. احتمال دارد تنها میزان درصد کمی از گوساله هایی که از طریق جنین آلوده شده اند علائم کلینیکی نئوسپوروزیس را داشته باشند. در دو گله گاو در کالیفرنیا 31% و 54% از گوساله ها قبل از خوردن آغوز تیتر مثبت پادتن نئوسپورا کانینم را داشته اند.
نئوسپوروزیس در سایر حیوانات
نئوسپوروزیس در بز
در گله های بز نژاد پیگمی (Pygmy goats) در کالیفرنیا و پنسیلوانیا و همچنین بزهای شیرده کاستاریکا (Castarica) سقط جنین ناشی از نئوسپورا کانینم گزارش شده است. دو جنین سقط شده مربوط به کالیفرنیا مورد بررسی های آسیب شناسی قرار گرفتند و کیست بافتی در هر دو جنین مشاهده شده است. جنین های آلوده پنسیلوانیا از گله بزی آورده شده بودند که به کرات سقط جنین، زاییده شدن بزغاله های مرده و همچنین بزغاله های ضعیف داشتند و در دو جنین آلوده که مورد آزمایش قرار گرفتند در قسمت میانی مغز آنها جراحات متعددی دیده شد این جراحات انسفالیتیس و ندولهای میکروگلیال همراه با نقاط کوچک نکروز شده بودند. سلولهای یک هسته ای در اطراف ندولها و تعداد متعددی کیست بافتی مشاهده گردیدند.
بزهای نژاد پیگمی به دلیل اندازه کوچکی که دارند می توانند بعنوان حیوان مدل جهت بررسی نئوسپوروزیس گاو مورد استفاده قرار گرفته شوند. لیندسی و همکاران(Lindsay et al1995b) 6 بز نژاد پیگمی را در مراحل مختلف آبستنی با تلقیح تاکی زوئیت های نئوسپور کانینم آلوده نمودند. زمان آلوده شدن بزها به روش زیر بوده است. بزهای شماره یک و دو در مرحله شروع آبستنی، بزهای شماره سه و چهار در اواسط آبستنی و بزهای شماره پنج و شش در مرحله آخر آبستنی آلوده شدند. بز شماره یک جنین اتولیز شده نئوسپورا کانینم را 30 روز پس از آلودگی سقط کرد. بز شماره دو دارای جنینی بود که در رحم مرده و سپس جذب شده بود. بز شماره سه دو بزغاله سالم زاییده بود و نئوسپورا کانینم در بافتهای آنها دیده نشد ولی در جفت آنها نئوسپورا دیده شد. بز شماره چهار یک بزغاله زنده و یک بزغاله مرده زاییده بود و نئوسپورا کانینم در بافتهای نوزاد مرده وجود داشت ولی در بزغاله زنده تک یاخته دیده نشد. بز شماره پنج و شماره شش که در ماههای آخر آبستنی آلوده شده بودند بزغاله های ضعیفی زاییدند که در فاصله زمانی کوتاه تلف شدند و نئوسپورا کانینم از بافتهای آنها جدا نشد هر شش بز آلوده مجدداً آبستن شدند اما تمام آنها بزغاله هایی را زاییدند که از نظر کلینیکی طبیعی بوده و آلودگی به نئوسپورا کانینم نداشتند.
نئوسپوروزیس در گوسفند
در بررسیهای انجام شده تنها یک مورد درباره آلوده شدن بره از طریق جفت گزارش گردیده (b 1995 Hartly and Bridge) و بره زاییده شده ضعیف بوده و عدم تعادل نداشته و در سن یک هفتگی تلف شده است ولی تاکی زوئیت ها در جراحات بره مزبور دیده نشد و ضایعات جنینی بره کاملاً با ضایعات جنینی در گوساله شبیه بوده است. بطور کلی گوسفند نسبت به عفونت نئوسپورا کانینم بسیار حساس است. در یک بررسی دیگر تاکی زوئیت های نئوسپورا کانینم از راه داخل وریدی و داخل عضلانی به دو میش آبستن تلقیح شدند هر دو میش 25 و 26 روز پس از تلقیح نمونه آلوده بره های دوقلوی مرده سقط نمودند. جراحات ایجاد شده بیشتر در مغز و رشته های عصبی نخاع (Spinal cord)، عضلات و جفت گسترش داشته است.
نئوسپوروزیس در موش
نئوسپورا کانینم برای موش عفونی زا است. موش جهت بررسیهای بیولوژی، ایمونولوژی و شیمی درمانی نئوسپورا کانینم به عنوان حیوان مدل مورد استفاده قرار می گیرد. گسترش علائم کلینیکی نئوسپوروزیس در موش به نوع سویه تک یاخته و مقدار دز نئوسپورا ارتباط دارد. موش های اصلاح نشده سوییس وبستر (Out bred Swiss Webster) علائم حاد بیماری مشاهده نمی گردد و نئوسپورا کانینم در مغز آنها به کیست تبدیل می شود. با استفاده از سویه حاد نئوسپورا و دز بالای تاکی زوئیت و تزریق کورتن (Corticosteroids) علائم کلینیکی حاد نئوسپوروزیس در موش اصلاح نشده ظاهر می گردد.
در نئوسپوروزیس گسترش یافته در موش تاکی زوئیت ها در بافتهای متعددی قابل رویت می باشد ولی در نئوسپوروزیس مزمن نئوسپورا کانینم صرفاً در مغز و طناب نخاعی= (رشته های عصبی نخاع Spinal cord)دیده می شود. کیست ها معمولاً 21 روز پس از تلقیح ماده آلوده در اعصاب مرکزی (CNS) دیده می شوند و قطر آنها کمتر از 50 میکرون می باشد و مدت زمان عفونت در اندازه قطر کیست ها نقشی ندارد. در موشهایی که نقصان ایمنی دارند(Immuno deficient mice). نئوسپوروزیس به سرعت گسترش یافته و علائم حاد بیماری مشاهده می گردد.
موشهای اصلاح شده بالب سی(Inbred Balb/c) در مقایسه با موشهای اصلاح نشده حساسیت بیشتری نسبت به عفونت نئوسپورا کانینم دارند و ظهور بیماری بصورت حاد و یا مزمن در موشهای اصلاح شده نیز بستگی به سویه جدا شده، دز تزریقی نئوسپورا کانینم دارد. تک یاخته نئوسپورا کانینم در موشهای Balb/c از طریق جفت به جنین قابل انتقال می باشد. انتقال عمودی در موشهای اصلاح نشده نیز دیده می شود.
نئوسپوروزیس در سگ
در مورد نئوسپوروزیس در سگ اطلاعات محدودی در دسترس می باشد. بیشترین موارد حاد بیماری در سگهای جوانی که از طریق جفت آلوده شده بودند مشاهده شده است در سگهای جوان ابتدا فلجی خفیف پاهای عقب ظاهر شده سپس فلجی پیشرفته اندامهای خلفی بروز می نماید. علائم عصبی بیشتر در ارتباط با محلی است که انگل جایگزین شده، پاهای عقبی شدیدتر از دستها آزردگی را نشان می دهند. پاهای عقب بیش از اندازه از یکدیگر باز شده و مفاصل کاملاً سخت و بی حرکت هستند. سگهایی که فلج اندامهای خلفی دارند معمولاً هشیار هستند و ممکن است مدت چند ماه زنده مانده و سپس تلف شوند. بیماری ممکن است عوارض عمومی یا موضعی را ایجاد نماید، از طرفی امکان دارد آزردگیهای کلیه و سایر اعضاء بدن نیز مشاهده گردد. تورم پوستی (Dermatitis) ممکن است بصورت حاد مشاهده شود که نتیجه هجوم تعداد زیادی نئوسپورا کانینم به درم می باشد. سگها ممکن است در هر سنی آلوده شوند ولی نئوسپوروزیس فوق حاد و کشنده بیشتر در سگهای 8 تا 15 ساله گزارش شده است. سگهای ماده ای که بطور مزمن به بیماری مبتلا می شوند می توانند بیماری را به جنین منتقل نمایند. توله سگهای زاییده شده امکان دارد آلوده باشند ضمناً تاثیر جنس و نژاد در بروز بیماری بصورت حاد و مزمن نقش چندانی ندارند.
تشخیص
گرچه نشانیهای کلینیکی نئوسپوروزیس ناشی از نئوسپورا کانینم و توکسوپلاسموزیس ناشی از توکسوپلاسما گوندی با استفاده از میکروسکوپ نوری شبیه هستند، معذالک از نقطه نظر آنتی ژنهای غالب دو تک یاخته از یکدیگر قابل تشخیص می باشند. تاکی زوئیت های نئوسپورا کانینم و توکسوپلاسما گوندی با استفاده از میکروسکوپ الکترونی نیز تقریباً از یکدیگر متمایز هستند زیرا روپتری ها در تاکی زوئیت های نئوسپورا با تراکم بالای الکترون (Electron dense) همراه بوده در حالیکه روپتری های توکسوپلاسما مومی شکل بوده و حالت اسفنجی را دارند و تراکم الکترون هم ندارند. تعداد روپتری ها و وضعیت قرار گرفتن میکرونم ها نیز در هر دو تک یاخته بی نهایت متغیر است. کیست های بافتی نئوسپورا کانینم از کیست های بافتی توکسوپلاسما گوندی تقریباً قابل تشخیص هستند زیرا دیواره کیست در تک یاخته نئوسپورا ضخامتی برابر 4 میکرون دارد و بمراتب ضخیم تر از ضخامت کیست های توکسو پلاسما می باشند، ضمناً کیست های نئوسپورا کانینم بیشتر در بافتهای عصبی ظاهر می گردند در حالی که کیستهای توکسوپلاسما گوندی امکان دارد در سایر اعضاء بدن دام نیز دیده شوند. بطور کلی اختلاف کیست های بافتی در دو تک یاخته مزبور آن طوری که باید و شاید نمی تواند بطور قاطع وجه تمایز آنها از یکدیگر باشد بنابراین در تشخیص نئوسپوروزیس نکات زیر باید مد نظر قرارگیرند:
– بررسی سرمی گاو آلوده و جنین و همچنین بررسی میکروسکوپی و ماکروسکوپی بافتهای جنین سقط شده در تشخیص بیماری کمک شایانی می نمایند.
– مطلوب ترین روش این است که سرم گاو آلوده و جنین سقط شده بطور کامل جهت تشخیص به آزمایشگاه فرستاده شود و اگر ارسال جنین بطور کامل با مشکلی همراه است سر جنین برای تشخیص ارسال گردد.
– در شرایط فعلی هیچگونه اطلاع مشخصی که تک یاخته در چه قسمتی از مغز جنین جایگزین می گردد وجود ندارد و تمام قسمتهای مغز جهت بررسیهای آسیب شناسی باید مورد استفاده قرار گیرد. نئوسپورا کانینم در جنین های مومی شکل و جنین هایی که بافت مغزی آنها تقریباً بطور کامل لیز شده (متلاشی شده) دیده شده است وجود فرمهای مختلف نئوسپورا کانینم در سلولهای میزبان ممکن است بسیار محدود بوده و در مقاطع نسجی رنگ آمیزی شده با هماتوکسیلین و ائوزین بوضوح قابل رویت نیستند از طرفی رنگ آمیزی پادتن های اختصاصی نئوسپورا کانینم می تواند وجود میکروارگانیسم را مشخص نماید ولی همانطوریکه قبلاً اشاره شده است تاکی زوئیت های نئوسپورا کانینم غالباً در مغز جنین از نقطه نظر تعداد کم بوده و بیشتر مواقع فعال نیستند و در نتیجه مشکل است که بطور مطمئن وجود تاکی زوئیت در مغز کاملاً مشخص گردد.
– تاکی زوئیتهای نئوسپورا کانینم را می توان در محیط های مخصوص کشت سلول کشت داد و رشد و تکثیر تاکی زوئیتها در محیط کشت جهت تشخیص نئوسپوروزیس روش مناسبی می باشد. ضمناً یادآور می باشد که تاکی زوئیت ها در بیشتر سلولهای لاین کشت می شوند ولی عادت کردن آنها به محیط کشت سلول ممکن است حداقل دو ماه طول بکشد زیرا بیشتر مواقع نمونه های مورد استفاده برای کشت معمولاً دارای تعداد کمی میکروارگانیسم نئوسپورا می باشند.
– تزریق نمونه ای از جنین به حیوانات آزمایشگاهی برای تشخیص نئوسپوروزیس روش مناسبی میباشد و برای این منظور از موشهای اصلاح شده Balb/c و موشهای اصلاح شده(Swiss Webster) استفاده می شود.
– به منظور تشخیص نئوسپورا کانینم تستهای سرمی نظیر IFA ,ElISA ,HCI مورد استفاده قرار می گیرد.مزایا و معایب تستهای یاد شده در زیر شرح داده می شود:
– تست IFA در تشخیص نئوسپوروزیس تست اختصاصی است و عوامل متعددی که در اختصاصی بودن این تستها دخالت دارند عبارتند از:
1- سرم: معمولاً جهت کشت سلولهای نئوسپورا و تهیه آنتی ژن از محیطهای کشت نسج دارای سرم جنین گاو استفاده می شود و با توجه به اینکه نئوسپوروزیس مزمن در گاو بسیار گسترش دارد بنابراین سرمهای بکار برده شده ممکن است واجد پادتن نئوسپورا کانینم باشند و نتایج تست IFA با استفاده از این گونه سرمها با اشکال مواجه گردد و برای رفع مشکل می توان بجای سرم جنین گاو از سرم بز و سرم اسبی که عاری از پادتن نئوسپورا باشد استفاده نمود. از طرفی ایمونوگلوبولین های غیر اختصاصی یا پروتئین های دیگر موجود در محیط کشت با اتصال به آنتی گاما گلوبولین کونژوگه فلورسانس غیر اختصاصی ایجاد می نماید. بنابراین در مرحله نهایی کشت ضروری است با استفاده از سانتریفیوژ و شستشو حداقل برای چهار بار سرم و سایر پروتئینهای موجود در محیط کشت را جدا نموده و از سلولهای تاکی زوئیت خالص به عنوان آنتی ژن استفاده نمود. ضمناً در صورت مثبت بودن تست در تمام سطح تاکی زوئیت ها باید فلورسانس نشان داده شود و جزیی بودن و یا ناقص بودن فلورسانس سطح تاکی زوئیت ها نمی تواند دلیل بر مثبت بودن تست باشد.
2- در انجام تست IFA مناسبترین رقت سرم برای تیتر مثبت پادتن نئوسپورا کانینم نباید کمتر از 100/1 باشد، زیرا در رقت های کمتر امکان واکنشهای متقابل با سایر تک یاخته ها به خصوص توکسوپلاسما گوندی دیده شده است.
3- استفاده از تست IFA با سرم واجد پادتن نئوسپورا کانینم و مقایسه آن با سرمهای واجد پادتن های توکسوپلاسما گوندی، سارکوسیستیس و نوزوما (Sarcocystis ,neuzoma) ،(سارکوسیستیس موریسS.muris) ،سارکوسیستیس کروزیS.cruzi) و همچنین سرم هموندیا هموندی(Hamondia hammondia) واکنش متقابل نداشته اند.
واکنش های متقابل بین توکسوپلاسما گوندی و نئوسپورا کانینم با انجام تست الیزا و استفاده از آنتی ژنهای ناخالص دیده شده است ولی در صورت استفاده از آنتی ژنهای خالص الیزا همراه با ایسکام(ISCOM=Immuno stimulating complex) سرم های واجد پادتن نئوسپورا کانینم با سرم توکسوپلاسما گوندی واکنش متقابل نداشته اند بنابراین بکارگیری تست ایسکام الیزا (ISCOM-ElISA) در تشخیص نئوسپورا کانینم در مقایسه با تست IFA مناسبتر، با صرفه تر بوده و برای انجام تست دقت کمتری هم صرف می شود. از طرفی استفاده از پروتئین های نوترکیب نیز می تواند اختصاصی بودن تست الیزا را افزایش دهد.
نئوسپورا کانینم را با استفاده از مقاطع ایمونوهیستو شیمی و انجام تست IHC نیز می توان تشخیص داد معذالک معرفهای مورد استفاده برای انجام تست باید با دقت کافی تهیه و آماده شود زیرا در شرایط فعلی نتایج بدست آمده از این تست در آزمایشگاه های مختلف یکنواخت نیست. عوامل مختلفی که در بدست آوردن نتایج مطمئن دخالت دارند عبارتند از : نوع سرم تهیه شده از خرگوش، نوع آنتی ژن بکار برده شده ، مدت زمان کمون آزمایش، نوع تریپسین یا پپسین بکار برده شده و همچنین مصرف یا عدم مصرف آنزیم در آماده سازی بافتها
– تست آگلوتیناسیون تغییر داده شده (Modified agglutination) با استفاده از رقت سرمی25/1 و تست رنگی ( Dye test) یا تست کلاسیک سی بین فولدمن (Classical Sabin Foldman) با استفاده از رقت سرمی 16/1 در تشخیص نئوسپورا کانینم قابل استفاده می باشد و واکنش های متقابل این دو تست با سرم سایر تک یاخته ها به خصوص تک یاخته توکسوپلاسما گوندی بسیار ناچیز یا اصلاً وجود نداشته است. ضمناً لازم به یادآوری است که سقط جنین در گاوهای آلوده به نئوسپورا کانینم و سقط جنین گاو آلوده به توکسوپلاسما گوندی و سارکوسیستیس کروزی وجه تشابهی با هم ندارند زیرا:
1- در مورد سقط جنین توکسوپلاسمایی در گاو سند معتبری وجود ندارد و توکسوپلاسموز در گاو نمی تواند مشکل ساز باشد و در صورت ورود تک یاخته به بدن گاو سریعاً دفع می گردد و در نتیجه واکنش متقابل با توکسوپلاسما گوندی در گاو نمی تواند یک مشکل کاربردی با نئوسپورا کانینم باشد.
2- سقط جنین های مربوط به سارکوسیستیس کروزی در گاو کمیاب می باشد و بر خلاف نئوسپورا کانینم شیزونت های سارکوسیستیس کروزی اساساً در سلولهای پوششی جدار درونی رگها وجود دارند و مروزئیت های موجود در آنها فاقد روپتری بوده و در تست ایمونوهیستوشیمی پادتن های نئوسپورا کانینم شیزونت های سارکوسیستیس کروزی را رنگ نمی کنند.
بطور کلی نتایج تست های سرمی در تشخیص نئوسپورا کانینم باید با احتیاط تفسیر و تعبیر شوند به دلیل این که فعالیت سیستم ایمنی دام آلوده در مبارزه با نئوسپوروزیس وضع ثابت و پابرجایی ندارد. میزان تیتر مثبت پادتن شناور است (کم یا زیاد می شود) و تغییر تیتر پادتن بخصوص در مورد انگلهایی که بصورت کیست بافتی شکل می گیرند واضح تر است زیرا دیواره کیست مقاوم و ضخیم بوده و مانع از تاثیر سیستم ایمنی در روی تک یاخته می شود و حتی با پاره شدن کیستها امکان برگشت بیماری بصورت حاد یا فوق حاد وجود دارد ضمناً ضرورت دارد یاد آور شود که انجام یک تست سرمی مشخص بخصوص در گاوداریهایی که هنوز سقط جنین ناشی از نئوسپورا کانینم را حتی یکبار هم نداشته اند با دلایل کافی همراه نیست و در چنین مواقعی برای تشخیص قطعی سقط جنین مربوط به نئوسپورا کانینم استفاده از دو تست مختلف در دفعات متعدد حتی در فصول مختلف سال می تواند راه گشا باشد.
از طرفی لازم به تاکید است که عدم مثبت بودن تیتر سرم جنین نمی تواند دلیلی بر عدم وجود نئوسپوروزیس باشد بلکه به وضعیت سیستم ایمنی جنین ارتباط دارد و امکان دارد که به اندازه کافی تکامل نیافته باشد.
تشخیص نئوسپوروزیس در سگ
قبل از تلف شدن سگ علائم کلینیکی بوضوح می توانند در تشخیص نئوسپوروزیس کمک نمایند فلج گسترش یافته اندامهای خلفی در سگهای جوان بخصوص اگر تعدادی بیش از دو توله سگ مبتلا باشند می تواند به وجود بیماری مشکوک شد. در این بیماری در سگ پارامترهای هماتولوژی چندان تغییری نمی کند. افزایش سطح آنزیمهای موجود در سرم همراه با نکروز شدن میوسیت ها (Myocytes) ها و تصادفاً هپاتوسیتها(Hepatocytes) دیده می شود. آزمایشهای سرمی در تشخیص نئوسپوروزیس در سگ راه گشا هستند و آزمایش IFA متداول ترین تست در بررسی های سرمی می باشد. در یک بررسی انجام شده سگهایی که علائم کلینیکی نئوسپورا کانینم را داشتند تمام آنها تیتر پادتن 1200/1 و حداکثر 600/1 را داشتند وجود پادتن در مایع نخاعی-مغزی (CSF=Cerebrospinal fluid) در تشخیص بیماری کمک می نماید.
تست IFA در کلیه بررسی های کاربردی می تواند تست اختصاصی باشد معذالک با توجه به اینکه ممکن است در سگهایی که بطور طبیعی آلوده شده اند واکنش های متقابل بسیار ضعیفی بین توکسوپلاسما و نئوسپورا دیده شود زیرا امکان آلودگی سگ به توکسو پلاسموز هم وجود دارد. لذا توصیه می شود برای شناسایی نئوسپورا کانینم در سگها از تست ایسکام الیزا (ISCOM ELISA) استفاده نمایند.
بیوپسی عضلات و آزمایشهای آسیب شناسی آنها و ریه ها و اکسودای پوستول های پوستی Dermal Pustular exudate) ) نئوسپورا کانینم قابل رویت می باشد. تست هیستوشیمی نیز می تواند باعث تمایز این دو تک یاخته از یکدیگر باشد. داروهای مختلفی جهت درمان نئوسپوروزیس در سگ مورد آزمایش قرار گرفته اند. سولفانامیدها، پیری متامین(Pyrimethamine) و کلیندامایسین(Clindamycin) یا مخلوطی از سولفانامید و پیری متامین در درمان نئوسپوروزیس تاثیر نسبی داشته است. از طرفی دارویی که از انتقال نئوسپورا کانینم از سگ ماده آبستن به جنین جلوگیری نماید در دسترس نیست.
درمان تجربی
تاکنون در مورد اثر درمانی بیش از 40 نوع دارو در روی تاکی زوئیت های نئوسپورا در محیط کشت بررسی های لازم انجام شده و نتایج نسبتاً قابل توجهی نیز از این بررسی ها به دست آمده است. کشت تاکی زوئیت ها در بررسی اثر درمانی راه مناسبی است زیرا در فاصله زمان کوتاهی می توان اثر درمانی داروهای جدید را مورد آزمایش قرار داد. داروهایی که اثر درمانی آنها بر ضد نئوسپوروزیس در محیط کشت مورد استفاده قرار گرفته اند عبارتند از:
سولفانامیدهای متعدد مثل سولفادیازین (Sulfadiazine) سولفادی متوکسین (Sulfadimethoxine) ،سولفامرازین (Sulfamerazine)، سولفاکینوکسالین (Sulfaquinoxaline)، سولفاتیازول (Sulfathiazole) ممانعت کننده ها (Inhibitors)، آیونوفوروس آنتی بیوتیک (Ionophores antibiotics)مثل: لازالوسید (Lasalocide)، مادورامایسین (Maduramycine)، موننسین (Monensins)،ناراسین (Narasin) ،سالینومایسن (Salinomycine)، ماکرولیدها (Macrolides) مثل:آزیترومایسینAzithromycine)، کلاریترومایسین (Clarithromycin)، ماینوسیکلین (Minocycline)، آنتی بیوتیکها و لینکوزامید آنتی بیوتیک(Lincosamide antibiotics) و سولفانامید ها می باشند تمام آنها اثر درمانی مثبتی بر ضد تک یاخته داشته اند.
آرپرینوسید (Arprinocide)، نیفروفورازون (Nitrofurazone) و روبینیدین (Robenidine)، دکوکوینات (Decoquinate) و دیک لازوریل (Diclazuril) هم در کشت سلولی بر ضد تاکی زوئیت های نئوسپورا اثر درمانی داشته اند. آمپرولیم (Amprolium)، مترونیدازول (Metronidazole)، پارامومایسین ( Paromomycine) و رکسارزن (Roxarsone) اثر درمانی نسبتاً ضعیفی بر ضد تاکی زوئیت ها داشته اند و یا اینکه اصلاً اثر درمانی نداشته اند برای افزایش اثر درمانی دارو بر ضد تاکی زوئیت ها از ترکیب دو یا سه دارو استفاده شده است. مثلاً ترکیب پری متامین (Pyrimethamine)، اورمزوپرین (Ormezoprin)، تری متوپریم (trimethoprim) و دیاوریدین (Diaveridine) همراه با سولفانامید ها بر ضد تاکی زوئیت ها در کشت سلول مورد آزمایش قرار گرفته اند که اثر درمانی بهتری بر ضد تک یاخته نشان داده اند. درمورد اثر درمانی دارو در روی حیوانات مبتلا بررسی های کمی انجام شده است. آمپرولیوم(Amprolium) بر مبنای 4 تا 20 میلی گرم در آب آشامیدنی به طور روزانه به مدت 3 روز به موشهای آلوده به نئوسپوروزیس خورانده شد ولی نتایج درمانی رضایت بخشی بدست نیامده. در یک بررسی دیگر سولفادیازین بر مبنای 2 میلی گرم برای هر موش در آب آشامیدنی به موشهای آلوده به مدت سه روز خورانده شد. در 50% موشها داروی خورانده شده از گسترش نئوسپوروزیس جلوگیری کرده است. به طور کلی داروهای بکار برده شده تا کنون اثر درمانی قابل توجهی در روی موشهای آلوده به نئوسپوروزیس نداشته اند.
پیشگیری و کنترل نئوسپوروزیس در گاوداریهای سالم
در گاوداریهای سالم اقدامات احتیاطی برای جلوگیری از ورود انگل نهایت باید مورد توجه قرار گیرد. بررسی تیتر پادتن در حیوانات آلوده بهترین روش برای اطمینان از عدم ورود انگل توسط حیوانات حامل به گاوداری می باشد. حیوانات خریداری شده باید تنها از گله هایی باشند که تیتر پادتن در آنها بررسی شده و نتیجه انجام تست منفی باشد. حتی اگر دقت کافی در خرید دام انجام شود امکان دارد نئوسپورا کانینم در گله گاو وجود داشته باشد بنابراین عوامل خطرزا در ارتباط با انتقال افقی باید به حداقل ممکن برسد. از دسترسی سگها (سگهای گله و سگهای وحشی) به گاوداری و غذای آنها و محل های زایمان باید جلوگیری شود. در مزرعه هایی که گاوها چرا می کنند امکان جلوگیری از ورود سگ به چراگاه وجود ندارد بنابراین آخورها و محل های نگهداری غذا باید کاملاً به دقت کنترل شوند تا از آلوده شدن آنها به مدفوع سگ جلوگیری شود. هر نوع وسیله یا وسایل مربوط به خوردن غذا در گاوداریهای همسایه باید به خوبی تمیز و ضدعفونی شده سپس در گاوداری مورد نظر از آن استفاده نمایند. برای جلوگیری از نئوسپوروزیس و عدم آلودگی گاوداری انجام آزمایشهای سرمی در مورد گاوهای سقط کرده، جنین های سقط شده و جفت های آنها توصیه می شود. منفی بودن تست سرمی در گاوهای گاوداری هایی که نئوسپوروزیس در آنها گزارش نشده می تواند تا حدودی دلیل عدم وجود بیماری باشد ولی ضرورت دارد کنترل عوامل خطرزا، رعایت اصول بهداشتی و مدیریت صحیح و منظم بطور دائم مد نظر باشد و تیتر مثبت پادتن در گاوی که سقط کرده است باید دلیل بر وجود نئوسپوراکانینم باشد به شرط این که در مورد سایر عوامل سقط جنین نیز نتیجه تستهای سرمی منفی باشد.
در گله گاوداری که برای تکثیر و افزایش زاد و ولد در نظر گرفته شده انجام تست سرمی هر یکسال یا هر دو سال برای اطمینان از عدم وجود نئوسپورا ضروری است.
پیشگیری و کنترل نئوسپوروزیس در گاوهای آلوده
مهمترین اقدامی که باید در چنین گاوداریهایی سریعاً انجام شود عبارت است از جلوگیری از گسترش سقط جنین ها و کم کردن ریسک انتقالهای عمودی و افقی که در نهایت میزان سقط جنین در گله در دراز مدت به حداقل برسد همانطور که در مورد گله گاوداریهای سالم توضیح داده شد کم کردن ریسک ورود مجدد انگل به داخل گاوداری بسیار قابل اهمیت است زیرا با ورود مجدد نئوسپورا کانینم از خارج تمام فعالیتهای انجام شده در مورد کنترل بیماری بی ارزش می گردد.ب ه منظور مشخص کردن گسترش عفونت نئوسپورا کانینم در مزرعه انجام سیستماتیک سرولوژی در حیوان جوان و مسن (گوساله های نوزاد قبل از خوردن آغوز و پس از گذشت شش ماه از آنها) ضروری است و بر مبنای نتایج سرمی انتخاب و پرورش و نگهداری جمعیت دامی (سرونگاتیو) فاقد تیتر مثبت باید پایه و اساس پیشگیری گسترش بیماری در درازمدت باشد.
در هر حال گاوداران باید به گاوهای آلوده به عنوان منشاء انتشار بیماری توجه نمایند زیرا وجود گاوهای آلوده می تواند از طریق انتقال عمودی و افقی بقیه گاوهای موجود در مزرعه را آلوده نماید به عبارت دیگر هرگاه گاو آلوده آبستن سقط نماید و جفت و جنین سقط شده طبق اصول بهداشتی دور ریخته نشود و سگ به آنها دسترسی داشته باشد. در نهایت سگ آلوده شده به همراه مدفوع خود اووسیست های نئوسپورا کانینم را دفع نموده که باعث آلودگی آب و علوفه مصرفی دام و گسترش آلودگی در مزرعه می گردد زیرا گاوهای سالم با مصرف غذا و آب آلوده در اسرع وقت به نئو سپورا کانینم آلوده می شوند و انتقال افقی کامل می گردد و منشا دیگری که می تواند در انتشار نئوسپوروزیس نقش داشته باشد سایر حیوانات اهلی و وحشی موجود در مزرعه یا خارج از مزرعه می باشد.
واکسن نئوسپورا کانینم
واکسن کشته شده نئوسپورا کانینم بطور مشروط در دسامبر 1998 در آمریکا مورد تایید قرار گرفته و در بازار موجود است. واکسن دو بار در مراحل اولیه آبستنی مصرف می گردد ولی عده ای از محققین معتقدند که تزریق واکسن در مراحل اولیه آبستنی ممکن است اثر سوئی روی جنین داشته و باعث مرگ جنین شود و توصیه می نماید که واکسن قبل از شروع آبستنی مصرف گردد. به طور کلی در مورد استفاده از واکسن عقاید ضد و نقیضی وجود دارد و بررسیهای بیشتری در مورد اثر بخشی واکسن و نداشتن عوارض جانبی آن باید انجام پذیرد.
نئوسپوروزیس در ایران
در ایران در مورد نئوسپوروزیس ناشی از نئوسپورا کانینم و سقط جنین های ناشی از این تک یاخته بجز موارد بسیار نامشخص اطلاع دقیقی در دسترس نیست و ضرورت دارد در مورد وجود نئوسپوروزیس و سقط جنین های ناشی از آن بررسی های دقیق تری انجام شود.
در مورد بررسی نئوسپوروزیس ضرورت دارد اطلاعات زیر نیز جمع آوری شود:
1- محل گاوداری آیا در محیط کویری است یا در نقاط کوهستانی؟
2- آیا در محل گاوداری مورد نظر گاوداریهای دیگری هم وجود دارد یا خیر؟
3- منشاٌ آب آشامیدنی از لوله کشی است یا از آب چاه می باشد و یا اینکه آب مورد نیاز دام از آب چشمه تامین می گردد؟
4- آیا در گاوداری، سگها رفت و آمد دارند؟و آیا خود دامدار سگ دارد یا خیر؟
5- اگر دامدار سگ داشته باشد علائم عصبی و علائم مشخص فلجی پاها در آن دیده شده است یا خیر؟
6- آیا برای تمیزی اصطبل آب باقیمانده در محل در مرتعی که گاوها رفت و آمد دارند پخش می شود یا خیر؟
7- بطور سالانه چه تعداد سقط جنین در گاوداری مورد نظر مشاهده شده است؟
8- بهتر است در یک منطقه مشخص تعداد گاوداریهای موجود در نظر گرفته شده و برای انجام تست های سرمی ابتدا بصورت راندم تعدادی دام مثلاً 10% خونگیری وبا تست سرمی مورد نظر تحت بررسی قرار گیرند در صورتیکه تعداد بیش از 10% تیتر مثبتی بالاتر از 100/1 داشته باشند کلیه گاوهای موجود در گاوداری مورد بررسی سرولوژیکی قرار گیرند
9- نمونه برداری در دو بار به فاصله 4 الی 6 ماه انجام شود تا اینکه وضعیت حاد بیماری مشخص گردد زیرا تیتر مثبت مرحله اول دلیل بیماری حاد نمی تواند باشد و تنها معرف آن است که میزبان با تک یاخته روبرو شده است.
10- تست IFA در مورد نئوسپورا کانینم می تواند کاملاً اختصاصی باشد مشروط بر اینکه تیتر مثبت با رقت 100/1 در نظر گرفته شود.
11- در تست ELISA در صورتیکه از پروتئین های خالص نئوسپورا کانینم و یا تست ISCOM- ELISA استفاده شود ویژگیهای تست افزایش می یابد.
12- برای انجام تست IHC می توان از سرم پلی کلونال تهیه شده از خرگوش ایمن شده در مقابل نئوسپورا کانینم استفاده نمود.
13- در بررسی های سرمی با تیتر مثبت پادتن نئوسپورا ضرورت دارد از گوساله های نوزاد هم قبل از خوردن آغوز تست سرمی انجام شود.
14- در بررسی های Bioassay بهتر است تمام جنین سقط شده به آزمایشگاه فرستاده شود ، در غیر این صورت سر جنین به آزمایشگاه منتقل شود.
15- برای نگهداری مغز یا اندامهای دیگر جنین سقط شده بهتر است نمونه مورد نظر با سه برابر وزن خود با تامپونی با PH=7.2 صلایه شده و سپس به نسبت 10% گلیسیرین به آن اضافه شده در شیشه های کوچک تقسیم و سپس در یخچال -70 C نگهداری شود.
16- برای انجام تست های Bioassay بهتر است از موش اصلاح شده بخصوصBalb/c استفاده شود.
فهرست معانی:Glossary
مجموعه راسی 1- Apical complex
توده بی شکل 2- Artifact
قابلیت رنگ آمیزی با املاح نقره 3- Argyrophilic
متلاشی شدن بافت بوسیله آنزیمها 4- Autolyzed
اسهال ویروسی گاو 5- B.V.D
فرمهایی از تک یاخته هستند که بسیار کمتر تقسیم می شوند 6- Bradyzoite
آغوز 7- Colostrum
رشته های مارپیچی در هم پیچیده ای که در داخل حلقه قطبی جای گرفته اند 8- Conoid
گاوداریهایی که امکان دارد به روش بسته نگه داری شوند 9- Dry lot dairies
جونده وحشی 10- Gerbil
سقط جنین گاو در یک منطقه محدود 11 – Endemic bovine abortion
آزردگیهای اعصاب مرکزی 12- Gliosis
دستگاه گلژی 13- Golgi complex
تقسیم تک یاخته در درون تک یاخته مادر به روش خاصی از مروگونی 14- Endodyogeny
عفونت ویروسی قسمتهای ابتدایی دستگاه تنفس در گاو 15- IBR
فرمول خاصی که برای شناسایی بیماری توسط کخ دانشمند آلمانی ارائه شده است 16- Kochs postulates
مومیایی شده 17- Mummified
دانه های سنجاقی شکل هستند که در قسمت قدامی تک یاخته قرارداند 18- Micronemmes
منافذ بسیار کوچکی هستند که برای گرفتن مواد غذایی مورد استفاده قرار می گیرند 19- Micropores
فلج عصبی – عضلانی 20- Neuromascular paralysis
بیماری عصبی-عضلانی 21- Neuromoscular disease
رنگ اسید شیف 22- PAS: Periodic acid shiff stain
فضای روشن یا حفره مانند در درون سیتوپلاسم سلول میزبان 23- Parasitophorous vacuole
غشاء یا لایه سیتوپلاسمی 24- Plasmalemma
قبل از تولد 25- Prenatally
بعد از تولد 26- Postnatally
رشته های متعدد و منظم در درون تک یاخته 27 – Septa
تعداد لوله های بسیار کوچک ظریفی هستند که از حلقه قطبی به عقب کشیده می شود 28-Subpellicular tubules
کیست بافتی 29- Tissue cyst
فرمی از تک یاخته که سریع تقسیم می شوند 30- Tachyzoite
تاول پوستی دارای مایع شفاف 31 – Vesicle
شکل 1: نمودار چرخه زندگی نئوسپورا کانینم

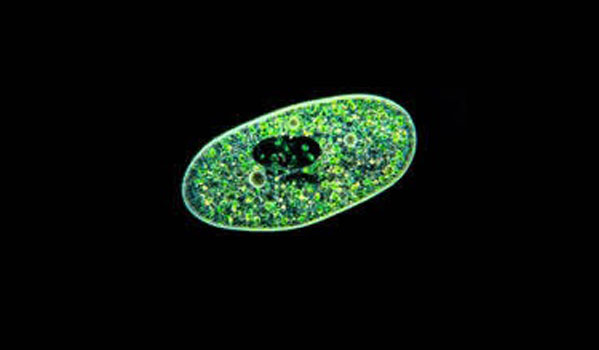
شکل شماره 2: تاکی زوئیتهای نئوسپورا کانینم که در سلولهای سیتوپلاسم انسان کشت داده شده است

اشکال A تا D شامل اسلایدهایی است که با متانول فیکسه شده و با رنگ گیمسا رنگ آمیزی شده است
A : تاکی زوئیت های تقسیم شده که در انتهای یک طرف به باقی مانده تک یاخته اولیه متصل می باشند.
B: یک جفت تاکی زوئیت واقع در واکوئل پارازیتوفوروس .
C: چهار تاکی زوئیت که در یک انتها به باقی مانده تک یاخته اولیه متصل می باشند.
D : شش تاکی زوئیت واقع در واکوئل پارازیتوفوروس
E: میکروگراف(Micrograph) تهیه شده با میکروسکوپ الکترونی(Transmission electron)
c: تاکی زوئیت همراه با کونوئید mi: تعداد متعددی میکرونم
mt : میتوکوندریم n : هسته r : هفت رپتری که یکی از آنها تا انتهای خلفی هسته کشیده شده است
خط میزان (Bar) : 0.5 میکرون
F : تاکی زوئیت های تقسیم شده ، میکروگراف با میکروسکوپ الکترونی(Transmission electron) تنها تعداد کمی رپتری ، میکرونم و شبکه لوله ای در حفره پارازیتوفوروس دیده می شود.
خط میزان (Bar):0.57 میکرون
اقتباس از مقاله دوبی وهمکاران در مجله انگل شناسی جلد 67 دامپزشکی از صفحه 1 تا 59 ((1996
شکل شماره 3: تاکی زوئیت های نئوسپورا کانینم و کیستهای بافتی در مقاطع سیستم اعصاب مکزی گاوی که به طور طبیعی آلوده

خط میزان(Bar): 10 میکرون که شامل A تا G می باشد.
A: رنگ آمیزی با Immuno histochemical stain , و B تا G رنگ آمیزی با هماتوکسیلین – ائوزین(H & E )
A : شامل دو تاکی زوئیت نئوسپورا کانینم در میان سلولهای نکروز شده میزبان
B: یک گروه دیواره سلولی که تاکی زوئیت ها در آنه حفظ شده است
C: تاکی زوئیت های داخل سلولی در درون یک نرون
D: بافت کیستی قابل شناسایی واجد هشت برادی زوئیت ، دیواره کیست خیلی نازک می باشد.
F: کیست بافتی در درون نرون، دیواره کیست ضخیم بوده ولی برادی زوئیت ها کاملاً مشخص نیستند.
G: کیست بافتی با برادی زوئیت های کشیده که در درون دیواره ضخیم کیست جای دارند. هسته سلول میزبان در انتهای پایین سلول قرار دارد.
اقتباس از مقاله دوبی وهمکاران در مجله انگل شناسی دامپزشکی ((1996
شکل شماره 4 : کیست بافتی نئوسپورا کانینم در مغز موش

کیست بافتی در مغز له شده موشی که دوازده ماه قبل با نئوسپورا کانینم آلوده شده است. دیواره کیست ضخیم بوده و واجد برادی زوئیت های کشیده می باشد.
اقتباس از مقاله دوبی و همکاران در مجله انگل شناسی دامپزشکی (1996